Khi có tia lửa điện hoặc ở nhiệt độ cao, nitrogen tác dụng trực tiếp với oxygen tạo ra hợp chất X. Công thức của X là
Phương trình phản ứng minh họa
N2 + O2 2NO.
Khi có tia lửa điện hoặc ở nhiệt độ cao, nitrogen tác dụng trực tiếp với oxygen tạo ra hợp chất X. Công thức của X là
Phương trình phản ứng minh họa
N2 + O2 2NO.
Nitrgen thể hiện tính khử trong phản ứng với chất nào sau đây?
Nitrgen thể hiện tính khử trong phản ứng với oxygen.
0N2 + O2 2N+2O.
Nung nóng 4,8 gam Mg trong bình phản ứng chứa 1 mol khí N2. Sau một thời gian, đưa bình về nhiệt độ ban đầu, thấy áp suất khí trong bình giảm 5% so với áp suất ban đầu. Thành phần phần trăm Mg đã phản ứng là
Áp suất giảm là do N2 đã phản ứng
Áp suất tỉ lệ thuận với số mol
→ nN2 phản ứng = 1.5% = 0,05 mol
Phương trình hóa học
3Mg + N2 Mg3N2
0,15 → 0,05
Hỗn hợp khi X gồm N2 và H2 có tỉ khối hơi so với He bằng 1,8. Đun nóng trong bình kín một thời gian (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối hơn so với He bằng 2. Hiệu suất phản ứng tổng hợp NH3 là
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có:
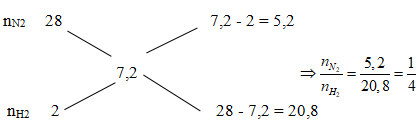
Chọn nN2 = 1 mol; nH2 = 4 mol
Phương trình phản ứng hóa học
| N2 | + 3H2 | ⇔ NH3 | |
| Ban đầu | 1 | 4 | 0 |
| Phản ứng | x | 3x | 2x |
| Sau phản ứng | 1- x | 4- 3x | 2x |
Theo phương trình ta thấy:
nhh khí sau phản ứng = (1–x) + (4–3x) + 2x = 5 – 2x
Áp dụng định luật bảo toàn khối lượng ta có:
mX = mY ⇔ nX.MX = nY.MY
Hiệu suất phản ứng tính theo N2 vì H2 dư:
H = 0,25 : 1 .100% = 25%
Có thể thu được nitrogen từ phản ứng nào sau đây?
Đun nóng dung dịch bão hòa NaNO2 với NH4Cl.
NaNO2 + NH4Cl NaCl + N2 ↑ + 2H2O
Ứng dụng nào sau đây không phải của nitrogen?
Ứng dụng không phải của nitrogen là: Sản xuất phân lân
Nhiệt phân chất nào sau đây thu được N2?
Phương trình nhiệt phân
NH4NO2 N2 + 2H2O.
Phản ứng nào dưới đây Nitrogen thể hiện tính khử
N2 thể hiện tính khử trong phản ứng với oxygen
0N2 + O2 2N+2O
Trong phản ứng với kim loại và hydrogen tác dụng với nitrogen thể hiện tính oxi hóa.
Vị trí của nitrogen (N) trong bảng hệ thống tuần hoàn là:
Nitrogen nằm ở ô 7 có cấu hình electron: 1s22s22p3
=> chu kì 2, nhóm VA trong bảng tuần hoàn.
Trong những nhận xét dưới đây, nhận xét nào là đúng?
Vì có liên kết 3 nên phân tử nitơ rất bền và ở nhiệt độ thường nitrogen khá trơ về mặt hóa học.
Để loại bỏ các khí HCl, Cl2, CO2 và SO2 có lẫn trong khí N2 người ta sử dụng lượng dư dung dịch
Để loại bỏ các khí HCl, Cl2, CO2 và SO2 có lẫn trong khí N2 người ta sử dụng lượng dư dung dịch Ca(OH)2 vì các tạp chất khí tác dụng với Ca(OH)2 bị giữ lại trong dung dịch, N2 không phản ứng sẽ thoát ra.
2HCl + Ca(OH)2 → CaCl2 + 2H2O
4Cl2 + 2Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
SO2 + Ca(OH)2 → CaSO3↓ + H2O.
Cho hỗn hợp khí X gồm N2, Cl2, SO2, CO2, H2 qua dung dịch NaOH dư, người ta thu được các khí thoát ra gồm:
Các khí bị giữ lại trong dung dịch NaOH là: Cl2, SO2, CO2
2NaOH + Cl2 → NaCl + NaClO + H2O
2NaOH + SO2 → Na2SO3 + H2O
2NaOH + CO2 → Na2CO3 + H2O
=> 2 khí thoát ra là N2 và H2
Nitrogen là chất khí phổ biến trong khí quyển trái đất và được sử dụng chủ yếu để sản xuất ammonia. Cộng hóa trị và số oxi hóa của nguyên tố N trong phân tử N2 là:
N2 công thức cấu tạo là : N≡N → N có cộng hóa trị là 3
N2 là đơn chất → N có số oxi hóa là 0.
Khối lượng NaNO2 cần dùng trong phòng thí nghiệm để thu được 3,36 lít N2 (đktc) là:
Phương trình phản ứng hóa học
NH4Cl + NaNO2 N2 + NaCl + 2H2O
Theo phương trình:
nNaNO2 = nN2 = 3,36:22,4 = 0,15 mol
⇒ mNaNO2 = 0,15.69 = 10,35 gam.
Cho 2a mol N2 và 3a mol H2 vào bình kín nung nóng với điều kiện thích hợp thu được V lít NH3 (đktc) biết hiệu suất phản ứng là 35%. Mối liên hệ giữa V và a là
Phương trình hóa học
N2 + 3H2 2NH3.
Từ phương trình hóa học ta có tỉ lệ:
⇒ hiệu suất tính theo H2
Với H% = 35% ta có nH2 phản ứng = 3a.35% = 1,05a mol
⇒ nNH3 = 1,05a.2/3 = 0,7a mol
⇒ VNH3 = 0,7a.22,4 = 15,68a (lít)
=> V = 15,68a.
