Bài thực hành 5
Bài thực hành 5: Điều chế - Thu khí hiđro và thử tính chất của khí hiđro gồm nội dung chi tiết 3 thí nghiệm về điều chế khí hiđro, thu khí hiđro và hiđro khử đồng (II) oxit.
I. Thí nghiệm 1: Điều chế khí hidro từ axit clohiđric HCl, kẽm. Đốt cháy khí hiđro trong không khí
1. Cách tiến hành
- Lắp dụng cụ như hình sau:
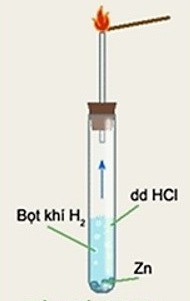
- Cho vào ống nghiệm 3ml dung dịch axit clohiđric HCl và 3 – 4 hạt kẽm Zn.
- Đậy ống nghiệm bằng nút cao su có ống dẫn khí xuyên qua.
- Sau khi thử độ tinh khiết, khẳng định dòng khí hiđro không có lẫn oxi (hoặc chờ khoảng một phút cho khí hiđro đẩy hết không khí ra khỏi ống nghiệm), sau đó đưa que đóm đang cháy vào đầu ống dẫn khí.
2. Hiện tượng - Giải thích
- Có bọt khí thoát ra từ mặt viên kẽm, mảnh kẽm tan dần.
2HCl + Zn → ZnCl2 + H2
- Đốt khí thoát ra từ đầu ống thí nghiệm, khí cháy trong không khí với ngọn lửa xanh mờ (khí H2).
2H2O ![]() O2 + 2H2
O2 + 2H2
II. Thí nghiệm 2: Thu khí hiđro bằng cách đẩy không khí
1. Cách tiến hành
- Lắp dụng cụ như hình sau:

- Úp một ống nghiệm lên đầu ống dẫn khí hidro sinh ra.
- Sau một phút, giữ cho ống nghiệm đứng thẳng và miệng ống úp xuống dưới, đưa miệng ống nghiệm vào gần sát ngọn lửa đèn cồn.
2. Hiện tượng – Giải thích
- Khi cho kẽm vào dung dịch HCl ta thấy sủi bọt khí:
Zn + 2HCl → ZnCl2 + H2
- Khí hiđro sinh ra theo ống dẫn khí vào đẩy không khí,đẩy nước ra và chiếm chỗ trong lọ.
- Đưa lọ đựng khí hiđro lại gần ngọn lửa đèn cồn: nếu hiđro tinh khiết chỉ nghe tiếng nổ nhỏ.
2H2O ![]() O2 + 2H2
O2 + 2H2
III. Thí nghiệm 3: Hiđro khử đồng (II) oxit
1. Cách tiến hành
- Lắp dụng cụ như hình sau:

- Cho vào ống nghiệm khoảng 10 ml dung dịch axit clohiđric loãng và 4 – 5 viên kẽm.
- Đậy ống nghiệm bằng nút cao su có ống dẫn thủy tính xuyên qua, ở đầu ống thủy tinh này được uốn gấp khúc chữ V có chứa một ít bột đồng (II) oxit CuO.
- Sau khi khẳng định dòng khí hidro không có lẫn oxi, dùng đèn cồn hơ nóng mạnh ở chỗ có CuO.
3. Hiện tượng – giải thích
- CuO từ màu đen chuyển dần thành màu đỏ (đồng kim loại), đồng thời có hơi nước thoát ra.
- Phương trình hóa học:
CuO + H2 ![]() Cu + H2O
Cu + H2O
Sắp xếp theo
Xóa
Gửi bình luận
-
Chương 1: Chất - Nguyên tử - Phân tử
-
Chương 2: Phản ứng hóa học
-
Chương 3: Mol và tính toán hóa học
-
Chương 4: Oxi - Không khí
-
Chương 5: Hiđro - Nước
-
Chương 6: Dung dịch







