Acid
I. Khái niệm acid
Acid là những hợp chất trong phân tử có nguyên tử hydrogen liên kết với gốc acid. Khi tan trong nước, acid tạo ra ion H+.
Ví dụ:
| Tên acid | Công thức hóa học | Dạng tồn tại của acid trong dung dịch | |
| Cation (ion dương) |
Anion (ion âm) Gốc acid |
||
| Hydrochloric acid | HCl | H+ | Cl- |
| Nitric acid | HNO3 | H+ | NO3- |
| Sulfuric acid | H2SO4 | H+ | SO42- |
II. Tính chất hoá học
Acid thường tan được trong nước, dung dịch acid làm đổi màu giấy quỳ từ tím sang đỏ.
Khi dung dịch acid phản ứng với một số kim loại như magnesium, sắt (iron), kẽm (zinc), … nguyên tử hydrogen của acid được thay thế bằng nguyên tử kim loại để tạo thành muối và giải phóng ra khí hydrogen.
Ví dụ 1: Mg tác dụng với dung dịch H2SO4 loãng
| Mg + | H2SO4 | → MgSO4 | +H2 |
| Magnesium | Sulfuric acid | Magnesium sulfate | Hydrogen |

Mg tác dụng với dung dịch H2SO4 loãng
Ví dụ 2:
Fe + 2HCl → FeCl2 + H2
Zn + 2HCl → ZnCl2 + H2.
III. Một số acid thông dụng
1. Sulfuric acid
Sulfuric acid (H2SO4) là chất lỏng không màu, không bay hơi, sánh như dầu ăn, nặng gần gấp hai lần nước. Sulfuric acid tan vô hạn trong nước và toả rất nhiều nhiệt.
Lưu ý: Tuyệt đối không tự ý pha loãng dung dịch sulfuric acid đặc.
Sulfuric acid là một trong các hoá chất được sử dụng nhiều trong các ngành công nghiệp và là hoá chất được tiêu thụ nhiều nhất trên thế giới.
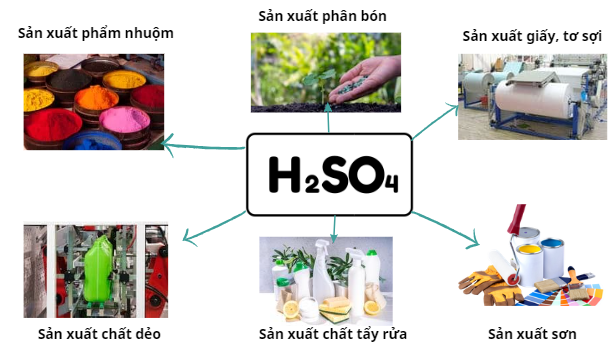
Một số ứng dụng Sulfuric acid
2. Hydrochloric acid
Dung dịch hydrochloric acid (HCl) là chất lỏng không màu.
Hydrochloric acid được sử dụng nhiều trong các ngành công nghiệp.




Hydrochloric acid có trong dạ dày, đóng vai trò quan trọng trong quá trình tiêu hoá như: thúc đẩy quá trình tiêu hoá thức ăn; kích thích ruột non và tuỵ sản xuất ra các enzyme tiêu hoá để phân giải chất béo, protein,…; tiêu diệt các vi khuẩn có hại từ bên ngoài đi vào dạ dày;… Khi nồng độ acid trong dạ dày lớn hơn hoặc nhỏ hơn quá mức cần thiết gây ảnh hưởng đến chức năng tiêu hoá của dạ dày nói riêng và sức khoẻ nói chung.
3. Acetic acid
Acetic acid (CH3COOH) là chất lỏng không màu, có vị chua. Trong giấm ăn có chứa acetic acid với nồng độ 2 – 5%.
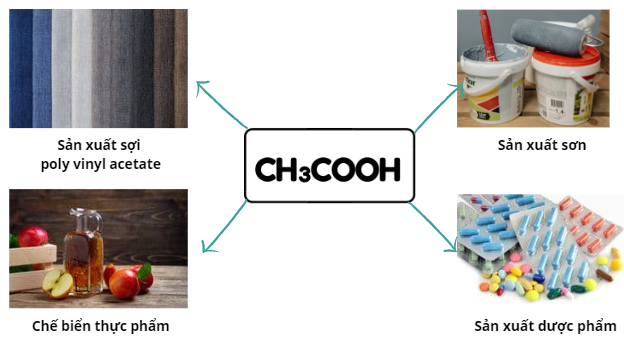
Một số ứng dụng Acetic acid
Nội dung cùng chủ đề
-
Chương 1. Phản ứng hóa học
-
Bài 1: Sử dụng một số hóa chất, thiết bị cơ bản trong phòng thí nghiệm
-
Bài 2: Phản ứng hóa học
-
Bài 3: Mol và tỉ khối chất khí
-
Bài 4: Dung dịch và nồng độ
-
Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
-
Bài 6: Tính theo phương trình hóa học
-
Bài 7: Tốc độ phản ứng và chất xúc tác
-
Ôn tập & kiểm tra Chương 1
-
-
Chương 2: Một số hợp chất thông dụng
-
Đề thi giữa học kì 1 Dạy nối tiếp
-
Đề thi giữa học kì 1 Dạy song song
-
Chương 3: Khối lượng riêng và Áp suất
-
Chương 4: Tác dụng làm quay của lực
-
Đề thi học kì 1 Dạy nối tiếp
-
Đề thi học kì 1 Dạy song song
-
Chương 5: Điện
-
Chương 6: Nhiệt
-
Chương 7: Sinh học cơ thể người
-
Bài 30: Khái quát về cơ thể người
-
Bài 31: Hệ vận động ở người
-
Bài 32: Dinh dưỡng và tiêu hóa ở người
-
Bài 33: Máu và hệ tuần hoàn của cơ thể người
-
Bài 34: Hệ hô hấp ở người
-
Bài 35: Hệ bài tiết ở người
-
Bài 36: Điều hòa môi trường trong của cơ thể người
-
Bài 37: Hệ thần kinh và các giác quan ở người
-
Bài 38: Hệ nội tiết ở người
-
Bài 39: Da và điều hòa thân nhiệt ở người
-
Bài 40: Sinh sản ở người
-
Ôn tập & kiểm tra Chương 7
-
-
Đề thi giữa học kì 2 Dạy nối tiếp
-
Đề thi giữa học kì 2 Dạy song song
-
Chương 8: Sinh vật và môi trường
-
Đề thi học kì 2 Dạy nối tiếp
-
Đề thi học kì 2 Dạy song song







