Tốc độ phản ứng và chất xúc tác
I. Khái niệm tốc độ phản ứng
Các phản ứng đốt cháy (cồn, than, củi, giấy …) xảy ra ngay lập tức, kèm theo sự toả nhiệt và phát sáng. Cồn, than, củi, giấy … biến đổi nhanh thành khí carbon dioxide và hơi nước.




Dây thép, cửa sắt … để ngoài không khí sau một thời gian có thể xuất hiện lớp gỉ màu nâu, xốp.
 |
 |
| Sắt bị gỉ | |
Ta nói rằng: Các phản ứng đốt cháy xảy ra với tốc độ rất nhanh, phản ứng của sắt với oxygen trong không khí ẩm xảy ra với tốc độ chậm hơn.
Tốc độ phản ứng là đại lượng đặc trưng cho sự nhanh, chậm của phản ứng hoá học.
Trong một phản ứng, để xác định tốc độ của phản ứng, ta có thể đo sự thay đổi của thể tích chất khí, khối lượng chất rắn hoặc nồng độ chất tan trong một khoảng thời gian.
II. Một số yếu tố ảnh hưởng đến tốc độ phản ứng
Tốc độ của phản ứng hoá học phụ thuộc vào các yếu tố như: nhiệt độ, nồng độ, diện tích bề mặt tiếp xúc của các chất tham gia phản ứng, chất xúc tác…
1. Ảnh hưởng của nồng độ đến tốc độ phản ứng
Khi tăng nồng độ của chất tham gia phản ứng, tốc độ của phản ứng tăng lên.
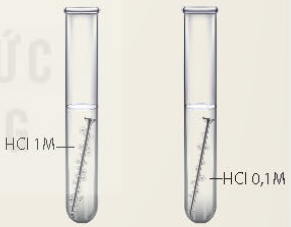
Ví dụ: Cho vào ống nghiệm (1) khoảng 5 mL dung dịch HCl 0,1 M; ống nghiệm (2) khoảng 5 mL dung dịch HCl 1 M.
Nhẹ nhàng đưa lần lượt 2 đinh sắt vào 2 ống nghiệm và thấy phản ứng ở ống nghiệm (2) (tức ống nghiệm chứa HCl 1 M) xảy ra nhanh hơn..
2. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
Khi tăng nhiệt độ của chất tham gia phản ứng, tốc độ của phản ứng tăng lên.
Ví dụ: Lấy hai cốc nước, một cốc nước lạnh và một cốc nước nóng, cho đồng thời vào mỗi cốc một viên C sủi. Phản ứng ở cốc nước nóng xảy ra nhanh hơn.

3. Ảnh hưởng của diện tích bề mặt tiếp xúc đến tốc độ phản ứng.
Khi tăng diện tích bề mặt tiếp xúc của chất tham gia phản ứng, tốc độ của phản ứng tăng lên.
Ví dụ: Để nung đá vôi thành vôi sống được nhanh hơn, cần đập nhỏ đá vôi.

4. Ảnh hưởng của chất xúc tác đến tốc độ phản ứng.
Chất xúc tác là chất làm tăng tốc độ phản ứng nhưng không bị biến đổi về khối lượng, tính chất hoá học sau phản ứng.
Ví dụ:
MnO2 làm tăng tốc độ phản ứng phân hủy H2O2.
Enzyme amylase có trong nước bọt và trong dịch tiết của hệ tiêu hóa giúp đẩy nhanh tốc độ phản ứng chuyển hóa tinh bột thành đường.
Với các phản ứng có sản phẩm tạo thành là chất khí hoặc chất kết tủa, để so sánh tốc độ của phản ứng có thể dựa vào việc quan sát tốc độ thoát khí hoặc tốc độ xuất hiện kết tủa.
Các yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng nhiều trong đời sống và sản xuất.
Trong công nghiệp, các quá trình sản xuất hoá chất thường dùng chất xúc tác để đẩy nhanh tốc độ phản ứng.
Nội dung cùng chủ đề
-
Chương 1. Phản ứng hóa học
-
Bài 1: Sử dụng một số hóa chất, thiết bị cơ bản trong phòng thí nghiệm
-
Bài 2: Phản ứng hóa học
-
Bài 3: Mol và tỉ khối chất khí
-
Bài 4: Dung dịch và nồng độ
-
Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
-
Bài 6: Tính theo phương trình hóa học
-
Bài 7: Tốc độ phản ứng và chất xúc tác
-
Ôn tập & kiểm tra Chương 1
-
-
Chương 2: Một số hợp chất thông dụng
-
Đề thi giữa học kì 1 Dạy nối tiếp
-
Đề thi giữa học kì 1 Dạy song song
-
Chương 3: Khối lượng riêng và Áp suất
-
Chương 4: Tác dụng làm quay của lực
-
Đề thi học kì 1 Dạy nối tiếp
-
Đề thi học kì 1 Dạy song song
-
Chương 5: Điện
-
Chương 6: Nhiệt
-
Chương 7: Sinh học cơ thể người
-
Bài 30: Khái quát về cơ thể người
-
Bài 31: Hệ vận động ở người
-
Bài 32: Dinh dưỡng và tiêu hóa ở người
-
Bài 33: Máu và hệ tuần hoàn của cơ thể người
-
Bài 34: Hệ hô hấp ở người
-
Bài 35: Hệ bài tiết ở người
-
Bài 36: Điều hòa môi trường trong của cơ thể người
-
Bài 37: Hệ thần kinh và các giác quan ở người
-
Bài 38: Hệ nội tiết ở người
-
Bài 39: Da và điều hòa thân nhiệt ở người
-
Bài 40: Sinh sản ở người
-
Ôn tập & kiểm tra Chương 7
-
-
Đề thi giữa học kì 2 Dạy nối tiếp
-
Đề thi giữa học kì 2 Dạy song song
-
Chương 8: Sinh vật và môi trường
-
Đề thi học kì 2 Dạy nối tiếp
-
Đề thi học kì 2 Dạy song song







