Định luật bảo toàn khối lượng và phương trình hóa học
I. Định luật bảo toàn khối lượng
1. Nội dung định luật bảo toàn khối lượng
Thí nghiệm: Chuẩn bị dung dịch barium chloride, sodium sulfate, cân điện tử, cốc thuỷ tinh. Trên mặt cân đặt 2 cốc, ghi tổng khối lượng 2 cốc.
Trên mặt cân đặt 2 cốc: cốc (1) đựng dung dịch barium chloride, cốc (2) đựng dung dịch sodium sulfate. Ghi tổng khối lượng 2 cốc.
Đổ cốc (1) vào cốc (2), lắc nhẹ để hai dung dịch trộn lẫn với nhau.
Quan sát thấy có một chất rắn màu trắng xuất hiện ở cốc (2).
Phản ứng xảy ra như sau:
Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride
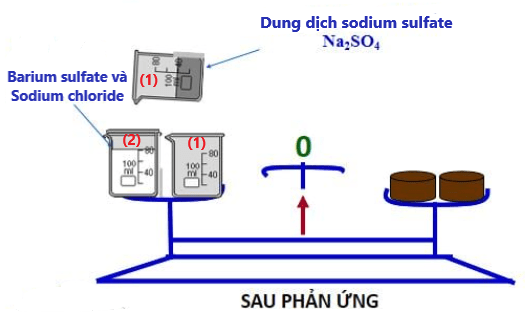
Đặt 2 cốc trở lại mặt cân. Thấy tổng khối lượng của các chất trước phản ứng với tổng khối lượng các chất sau phản ứng bằng nhau.
Giải thích: Trong các phản ứng hoá học, chỉ có liên kết giữa các nguyên tử thay đổi, còn số nguyên tử của mỗi nguyên tố hoá học vẫn giữ nguyên, vì vậy tổng khối lượng của các chất tham gia phản ứng bằng tổng khối lượng của các sản phẩm.
Nội dung định luật:
Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng các chất tham gia phản ứng.
2. Áp dụng định luật bảo toàn khối lượng
Trong phản ứng:
Barium chloride + Sodium sulfate → Barium sulfate + Sodium chloride
Theo định luật bảo toàn khối lượng:
mBarium chloride + mSodium sulfate = mBarium sulfate + mSodium chloride
Ví dụ 1: Biết khối lượng Barium chloride và Sodium sulfate đã phản ứng lần lượt là 20,8 gam và 14,2 gam, khối lượng của Barium sulfate tạo thành là 23,3 gam, ta sẽ xác định được khối lượng của Sodium chloride tạo thành?
Hướng dẫn
Theo định luật bảo toàn khối lượng:
mBarium chloride + mSodium sulfate = mBarium sulfate + mSodium chloride
⇒ mSodium chloride = mBarium chloride + mSodium sulfate - mBarium sulfate = 20,8 + 14,2 - 23,3 = 11,7(gam).
Tổng quát: Nếu trong phản ứng có n chất, khi biết khối lượng đã tham gia và tạo thành của (n - 1) chất, ta sẽ xác định được khối lượng của chất còn lại.
Ví dụ 2: Đốt cháy hoàn toàn 3,1 gam Phosphor trong không khí (có khí oxygen), ta thu được 7,1 gam hợp chất Diphosphor pentoxide (P2O5).
a) Viết phương trình phản ứng bằng chữ.
b) Tính khối lượng oxygen đã tham gia phản ứng.
Hướng dẫn
a) Phương trình chữ:
Phosphor + Oxygen → Diphosphor pentoxide
b) Theo định luật bảo toàn khối lượng:
mPhosphor + mOxygen = mDiphosphor pentoxide
⇒ mOxygen = mDiphosphor pentoxide - mPhosphor = 7,1 - 3,1 = 4 (gam)
II. Phương trình hóa học
1. Lập phương trình hóa học
Phản ứng hóa học giữa khí oxygen và khí hydrogen được biểu diễn bằng phương trình chữ như sau:
Khí hydrogen + khí oxygen → Nước
Thay tên các chất bằng công thức hóa học, được sơ đồ phản ứng:
H2 + O2 ----→ H2O
Trong phản ứng hoá học, tổng số nguyên tử của mỗi nguyên tố trong các chất tham gia phản ứng luôn bằng tổng số nguyên tử của nguyên tố đó trong các chất sản phẩm. Sau khi cân bằng, tổng số nguyên tử của mỗi nguyên tố ở hai vế của sơ đồ phản ứng bằng nhau.
Ta được phương trình hóa học:
2H2 + O2 → 2H2O
Các bước lập phương trình hoá học:
Bước 1: Viết sơ đồ của phản ứng
Al + O2 ----→ Al2O3
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố ở 2 vế.
Số nguyên tử Al và O ở 2 vế đều không bằng nhau
O có số nguyên tử nhiều hơn nên ta bắt đầu từ nguyên tố này trước.
O2 có 2 nguyên tử O còn Al2O3 có 3 nguyên tử O nên để cân bằng, ta đặt hệ số 2 trước Al2O3 và hệ số 3 trước O2.
Al + 3O2 ----→ 2Al2O3
Để cân bằng tiếp số nguyên tử Al ta cần đặt hệ số 4 trước Al ở vế trái
Bước 3: Viết phương trình hoá học của phản ứng
4Al + 3O2 → 2Al2O3
Lưu ý:
- Hệ số viết ngang với kí hiệu của các chất.
- Không thay đổi các chỉ số trong các công thức hoá học đã viết đúng.
- Nếu trong công thức hoá học, các chất ở 2 vế có những nhóm nguyên tử giống nhau, ta coi nhóm nguyên tử này như một "nguyên tố để cân bằng".
Ví dụ: Cân bằng phản ứng: Al + HCl ----→ AlCl3 + H2
Hướng dẫn
Trước phản ứng có 1 nguyên tử H và 1 nguyên tử Cl trong phân tử HCl; sau phản ứng có 3 nguyên tử Cl trong AlCl3; 2 nguyên tử H trong phân tử H2, do đó ta lấy bội chung nhỏ nhất của 3 và 2 là 6, đặt trước HCl, được:
Al + 6HCl ---→ AlCl3 + H2
Để cân bằng số nguyên tử H ta đặt hệ số 3 trước H2; để cân bằng số nguyên tử Cl ta đặt hệ số 2 trước AlCl3, được:
Al + 6HCl ---→ 2AlCl3 + 3H2
Cuối cùng để cân bằng số nguyên tử Al ta thêm hệ số 2 trước Al ở vế trái. Phương trình hoá học của phản ứng được hoàn thiện như sau:
2Al + 6HCl → 2AlCl3 + 3H2
2. Ý nghĩa của phương trình hoá học
Phương trình hóa học cho biết trong phản ứng hóa học, lượng các chất tham gia phản ứng và các chất sản phẩm tuân theo 1 tỉ lệ xác định.
Ví dụ 1: Xét phương trình phản ứng: 3Fe + 2O2 → Fe3O4.
Cứ 3 nguyên tử Fe phản ứng với 2 phân tử O2, tạo ra 1 phân tử Fe3O4
Số nguyên tử Fe : số phân tử O2 : Số phân tử Fe3O4 = 3:2:1
- Khi học về mol, ta biết được đó cũng là tỉ lệ mol:
Số mol Fe : số mol O2 : số mol Fe3O4 = 3:2:1
Vậy tỉ lệ số mol của các chất đúng bằng tỉ lệ hệ số của chúng trong phương trình hóa học.
- Từ tỉ lệ số mol, ta xác định được tỉ lệ về khối lượng các chất.
Khối lượng Fe : Khối lượng O2 : Khối lượng Fe3O4 = (56.3):(32.2):(232.1) = 168 : 64 : 232 = 21 : 8 : 29
Ví dụ 2: Giả thiết trong không khí, Iron tác dụng với oxygen tạo thành gỉ Iron (Fe2O3). Từ 5,6 gam Iron có thể tạo ra tối đa bao nhiêu gam gỉ iron?
Hướng dẫn
Phương trình hoá học: 4Fe + 3O2 → 2Fe2O3
Ta có tỉ lệ:
Số mol Fe : Số mol O2 : Số mol Fe2O3 = 4 : 3 : 2.
Từ tỉ lệ mol ta xác định được tỉ lệ khối lượng các chất:
Khối lượng Fe : Khối lượng O2 : Khối lượng Fe2O3
= (56 . 4) : (32 . 3) : (160 . 2) = 7 : 3 : 10.
Vậy cứ 7 gam Fe phản ứng hết với 3 gam O2 tạo ra 10 gam Fe2O3.
Do đó từ 5,6 gam Fe có thể tạo ra tối đa: ![]()
Nội dung cùng chủ đề
-
Chương 1. Phản ứng hóa học
-
Bài 1: Sử dụng một số hóa chất, thiết bị cơ bản trong phòng thí nghiệm
-
Bài 2: Phản ứng hóa học
-
Bài 3: Mol và tỉ khối chất khí
-
Bài 4: Dung dịch và nồng độ
-
Bài 5: Định luật bảo toàn khối lượng và phương trình hóa học
-
Bài 6: Tính theo phương trình hóa học
-
Bài 7: Tốc độ phản ứng và chất xúc tác
-
Ôn tập & kiểm tra Chương 1
-
-
Chương 2: Một số hợp chất thông dụng
-
Đề thi giữa học kì 1 Dạy nối tiếp
-
Đề thi giữa học kì 1 Dạy song song
-
Chương 3: Khối lượng riêng và Áp suất
-
Chương 4: Tác dụng làm quay của lực
-
Đề thi học kì 1 Dạy nối tiếp
-
Đề thi học kì 1 Dạy song song
-
Chương 5: Điện
-
Chương 6: Nhiệt
-
Chương 7: Sinh học cơ thể người
-
Bài 30: Khái quát về cơ thể người
-
Bài 31: Hệ vận động ở người
-
Bài 32: Dinh dưỡng và tiêu hóa ở người
-
Bài 33: Máu và hệ tuần hoàn của cơ thể người
-
Bài 34: Hệ hô hấp ở người
-
Bài 35: Hệ bài tiết ở người
-
Bài 36: Điều hòa môi trường trong của cơ thể người
-
Bài 37: Hệ thần kinh và các giác quan ở người
-
Bài 38: Hệ nội tiết ở người
-
Bài 39: Da và điều hòa thân nhiệt ở người
-
Bài 40: Sinh sản ở người
-
Ôn tập & kiểm tra Chương 7
-
-
Đề thi giữa học kì 2 Dạy nối tiếp
-
Đề thi giữa học kì 2 Dạy song song
-
Chương 8: Sinh vật và môi trường
-
Đề thi học kì 2 Dạy nối tiếp
-
Đề thi học kì 2 Dạy song song








