Muối
I. Khái niệm muối
Muối là những hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
Ví dụ:
H2SO4 + NaOH → Na2SO4 + H2O
Ion H+ của sulfuric acid bị thay thế bởi ion Na+.
2HCl + CuO → CuCl2 + H2O
Ion H+ của hydrochloric acid bị thay thế bởi ion Cu2+.
Muối ammonium được tạo ra khi thay thế ion H+ của acid bằng ion ammonium (NH4+) như NH4NO3 (ammonium nitrate), (NH4)2SO4 (ammonium sulfate),...
II. Tên gọi của muối
Tên gọi muối của một số acid được trình bày trong bảng sau:
| Acid | Muối | Ví dụ |
| Hydrochloric acid (HCl) | Muối chloride | Sodium chloride: NaCl |
| Sulfuric acid (H2SO4) | Muối sulfate | Copper(II) sulfate: CuSO4 |
| Phosphoric acid (H3PO4) | Muối phosphate | Potassium phosphate: K3PO4 |
| Carbonic acid (H2CO3) | Muối carbonate | Calcium carbonate: CaCO3 |
| Nitric acid (HNO3) | Muối nitrate | Calcium carbonate: CaCO3 |
III. Tính tan của muối
- Có muối tan tốt trong nước như: NaCl, CuSO4, Ca(NO3)2, …
- Có muối ít tan trong nước như: CaSO4, PbCl2, …
- Có muối không tan trong nước như: CaCO3, BaSO4, AgCl, …
Tính tan của một số muối được trình bày trong bảng tính tan sau:
| Gốc acid | Các kim loại | |||||||||||
|
K I |
Na I |
Ag I |
Mg II |
Ca II |
Ba II |
Zn II |
Pb II |
Cu II |
Fe II |
Fe III |
Al III |
|
| −Cl | t | t | k | t | t | t | t | t | t | t | t | t |
| −NO3 | t | t | t | t | t | t | t | t | t | t | t | t |
| =SO4 | t | t | i | t | i | k | t | k | t | t | t | t |
| =CO3 | t | t | k | k | k | k | k | k | - | k | - | - |
| ≡PO4 | t | t | k | k | k | k | k | k | k | k | k | k |
t: chất dễ tan trong nước
k: chất không tan (độ tan nhỏ hơn 0,01 g/100 g nước).
i: chất ít tan (độ tan nhỏ hơn 1 g/100 g nước).
(-): chất không tồn tại hoặc bị nước phân huỷ.
IV. Tính chất hoá học của muối
1. Tác dụng với kim loại
Dung dịch muối có thể tác dụng với kim loại tạo thành muối mới và kim loại mới.
Ví dụ:
2AgNO3 + Cu → Cu(NO3)2 + 2Ag
CuSO4 + Fe → FeSO4 + Cu
2. Tác dụng với acid
Muối có thể tác dụng với dung dịch acid tạo thành muối mới và acid mới.
Ví dụ:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
3. Tác dụng với base
Muối có thể tác dụng với dung dịch base tạo thành muối mới và base mới.
Ví dụ:
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
MgCl2 + 2KOH → Mg(OH)2↓ + 2KCl
4. Tác dụng với muối
Hai dung dịch muối có thể tác dụng với nhau tạo thành hai muối mới.
Ví dụ:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
V. Mối quan hệ giữa acid, base, oxide và muối
Mối quan hệ giữa acid, base, oxide và muối được tóm tắt trong sơ đồ sau:
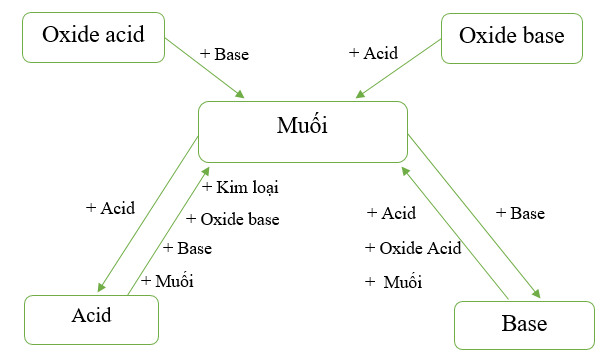 Hình 1: Sơ đồ mối quan hệ giữa acid, base, oxide và muối
Hình 1: Sơ đồ mối quan hệ giữa acid, base, oxide và muối
VI. Một số phương pháp điều chế muối
Muối có thể được tạo ra bằng các phương pháp sau:
- Cho dung dịch acid tác dụng với base.
Ví dụ:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
- Cho dung dịch acid tác dụng với oxide base.
Ví dụ:
3H2SO4 + Al2O3 → Al2(SO4)3 + 3H2O
- Cho dung dịch acid tác dụng với muối.
Ví dụ:
2HCl + CaCO3 → CaCl2 + CO2↑ + H2O
- Cho dung dịch base tác dụng với oxide acid.
Ví dụ:
2NaOH + CO2 → Na2CO3 + H2O
- Cho hai dung dịch muối tác dụng với nhau.
Ví dụ:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Nội dung cùng chủ đề
-
Bài mở đầu: Làm quen với bộ dụng cụ, thiết bị thực hành môn Khoa học tự nhiên 8
-
Chủ đề 1: Phản ứng hóa học
-
Bài 1: Biến đổi vật lí và biến đổi hóa học
-
Bài 2: Phản ứng hóa học và năng lượng của phản ứng hóa học
-
Bài 3: Định luật bảo toàn khối lượng, Phương trình hóa học
-
Bài 4: Mol và tỉ khối của chất khí
-
Bài 5: Tính theo phương trình hóa học
-
Bài 6: Nồng độ dung dịch
-
Bài 7: Tốc độ phản ứng và chất xúc tác
-
Ôn tập & kiểm tra Chủ đề 1
-
-
Chủ đề 2: Acid - Base - pH - Oxide - Muối
-
Đề thi giữa học kì 1 Dạy nối tiếp
-
Đề thi giữa học kì 1 Dạy song song
-
Chủ đề 3: Khối lượng riêng và áp suất
-
Chủ đề 4: Tác dụng làm quay của lực
-
Đề thi cuối học kì 1 Dạy nối tiếp
-
Đề thi cuối học kì 1 Dạy song song
-
Chủ đề 5: Điện
-
Chủ đề 6: Nhiệt
-
Chủ đề 7: Cơ thể người
-
Bài 27: Khái quát về cơ thể người
-
Bài 28: Hệ vận động ở người
-
Bài 29: Dinh dưỡng và tiêu hóa ở người
-
Bài 30: Máu và hệ tuần hoàn ở người
-
Bài 31: Thực hành máu và hệ tuần hoàn
-
Bài 32: Hệ hô hấp ở người
-
Bài 33: Môi trường trong cơ thể và hệ bài tiết ở người
-
Bài 34: Hệ thần kinh và các giác quan ở người
-
Bài 35: Hệ nội tiết ở người
-
Bài 36: Da và điều hòa thân nhiệt ở người
-
Bài 37: Sinh sản ở người
-
Ôn tập & kiểm tra Chủ đề 7
-
-
Đề thi giữa học kì 2 Dạy nối tiếp
-
Đề thi giữa học kì 2 Dạy song song
-
Chủ đề 8: Sinh thái
-
Chủ đề 9: Sinh quyển
-
Đề thi cuối học kì 2 Dạy nối tiếp
-
Đề thi học kì 2 Khoa học tự nhiên 8 - Đề 4







