Oxide
I. Khái niệm oxide
Oxide là hợp chất của oxygen với một nguyên tố khác.
Ví dụ: Na2O, CaO, Al2O3, CuO, CO2, NO, SO3,...
Kim loại hoặc phi kim tác dụng với oxygen tạo ra oxide.
Ví dụ:
4Fe + 3O2 → 2Fe2O3
Iron Oxygen Iron(II) oxide
S + O2 → SO2
Sulfur Oxygen Sulfur dioxide
Một số oxide có nhiều trong tự nhiên:
- Silicon dioxide (SiO2) – thành phần chính của cát.
- Aluminium oxide (Al2O3) – thành phần chính của quặng bauxite (boxit).
- Carbon dioxide (CO2) có trong không khí.
II. Phân loại oxide
Dựa vào khả năng phản ứng với acid và base, oxide được phân thành 4 loại như sau:
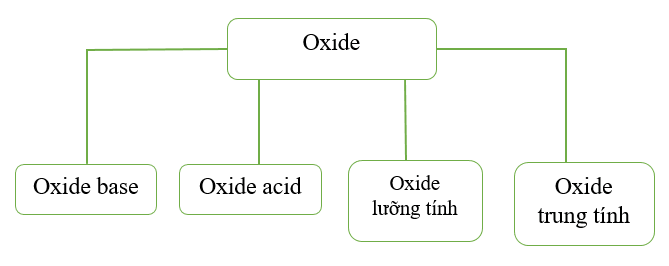
- Oxide base là những oxide tác dụng được với dung dịch acid tạo thành muối và nước. Đa số các oxide kim loại là oxide base, như: ZnO, CaO, CuO, …
- Oxide acid là những oxide tác dụng được với dung dịch base tạo thành muối và nước. Các oxide acid thường là oxide của các phi kim, như: CO2, SO2, SO3, P2O5, …
- Oxide lưỡng tính là những oxide tác dụng với dung dịch acid và tác dụng với dung dịch base tạo thành muối và nước. Một số oxide lưỡng tính thường gặp, như: Al2O3, ZnO, …
- Oxide trung tính là những oxide không tác dụng với dung dịch acid, dung dịch base. Một số oxide trung tính, như: CO, NO, N2O, …
III. Tính chất hoá học của oxide
1. Oxide base tác dụng với dung dịch acid
Oxide base tác dụng với dung dịch acid tạo thành muối và nước.
Ví dụ:
- CuO đã phản ứng với dung dịch HCl tạo ra CuCl2 theo phương trình hóa học sau:
CuO + 2HCl → CuCl2 + H2O
- Fe2O3 đã phản ứng với dung dịch H2SO4 tạo ra Fe2(SO4)3 theo phương trình hóa học sau:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
2. Oxide acid tác dụng với dung dịch base
Oxide acid tác dụng được với dung dịch base tạo ra muối và nước.
Ví dụ:
CO2 đã tác dụng với dung dịch Ca(OH)2 tạo ra CaCO3 không tan theo phương trình hóa học sau:
CO2 + Ca(OH)2 → CaCO3 + H2O
SO2 đã tác dụng với dung dịch NaOH tạo ra Na2CO3 theo phương trình hóa học sau:
SO2 + 2NaOH → Na2SO3 + H2O
Nội dung cùng chủ đề
-
Bài mở đầu: Làm quen với bộ dụng cụ, thiết bị thực hành môn Khoa học tự nhiên 8
-
Chủ đề 1: Phản ứng hóa học
-
Bài 1: Biến đổi vật lí và biến đổi hóa học
-
Bài 2: Phản ứng hóa học và năng lượng của phản ứng hóa học
-
Bài 3: Định luật bảo toàn khối lượng, Phương trình hóa học
-
Bài 4: Mol và tỉ khối của chất khí
-
Bài 5: Tính theo phương trình hóa học
-
Bài 6: Nồng độ dung dịch
-
Bài 7: Tốc độ phản ứng và chất xúc tác
-
Ôn tập & kiểm tra Chủ đề 1
-
-
Chủ đề 2: Acid - Base - pH - Oxide - Muối
-
Đề thi giữa học kì 1 Dạy nối tiếp
-
Đề thi giữa học kì 1 Dạy song song
-
Chủ đề 3: Khối lượng riêng và áp suất
-
Chủ đề 4: Tác dụng làm quay của lực
-
Đề thi cuối học kì 1 Dạy nối tiếp
-
Đề thi cuối học kì 1 Dạy song song
-
Chủ đề 5: Điện
-
Chủ đề 6: Nhiệt
-
Chủ đề 7: Cơ thể người
-
Bài 27: Khái quát về cơ thể người
-
Bài 28: Hệ vận động ở người
-
Bài 29: Dinh dưỡng và tiêu hóa ở người
-
Bài 30: Máu và hệ tuần hoàn ở người
-
Bài 31: Thực hành máu và hệ tuần hoàn
-
Bài 32: Hệ hô hấp ở người
-
Bài 33: Môi trường trong cơ thể và hệ bài tiết ở người
-
Bài 34: Hệ thần kinh và các giác quan ở người
-
Bài 35: Hệ nội tiết ở người
-
Bài 36: Da và điều hòa thân nhiệt ở người
-
Bài 37: Sinh sản ở người
-
Ôn tập & kiểm tra Chủ đề 7
-
-
Đề thi giữa học kì 2 Dạy nối tiếp
-
Đề thi giữa học kì 2 Dạy song song
-
Chủ đề 8: Sinh thái
-
Chủ đề 9: Sinh quyển
-
Đề thi cuối học kì 2 Dạy nối tiếp
-
Đề thi học kì 2 Khoa học tự nhiên 8 - Đề 4







