Định luật bảo toàn khối lượng và phương trình hóa học
I. Định luật bảo toàn khối lượng
Định luật bảo toàn khối lượng: Trong một phản ứng hoá học, tổng khối lượng của các chất sản phẩm bằng tổng khối lượng của các chất tham gia phản ứng.
Giải thích: Ta đã biết, trong phản ứng hóa học diễn ra sự thay đổi liên kết giữa các nguyên tử, còn số nguyên tử mỗi nguyên tố vẫn giữ nguyên và khối lượng của các nguyên tố không đổi, vì vậy tổng khối lượng của các chất được bảo toàn.
II. Phương trình hoá học
1. Tìm hiểu phương trình hoá học
Trong phản ứng hóa học, các chất phản ứng được viết bên trái trước kí hiệu "→" và chất sản phẩm được viết bên phải sau kí hiệu "→".
Sơ đồ tổng quát của một phản ứng:
Chất phản ứng → Sản phẩm
Ví dụ: phản ứng quang hợp
Nước + Carbondioxide → Glucose + Oxygen
Để thuận tiện cho việc trình bày ngắn gọn một phản ứng hoá học, người ta sử dụng các công thức hoá học biểu diễn cho các chất, gọi là phương trình hoá học.
Khi chuyển từ sơ đồ phản ứng thành phương trình hoá học, ta cần chú ý:
- Viết đúng công thức hoá học cho tất cả các chất.
- Sắp xếp theo đúng vị trí công thức hoá học của chất phản ứng và sản phẩm.
- Liên kết các công thức hoá học bằng dấu + và kí hiệu → để được một phương trình hoá học hoàn chỉnh.
Ví dụ: Phản ứng hoá học giữa đinh sắt (iron, Fe) và dung dịch sulfuric acid (H2SO4) tạo ra iron(II) sulfate (FeSO4) và khí hydrogen (H2).

Hình 1: Phản ứng hóa học giữa đinh sắt và dung dịch sulfuric acid
Ta biểu diễn thành sơ đồ phản ứng dạng chữ như sau:
Iron + Sulfuric acid → Iron(II) sulfate + Hydrogen
Thay tên các chất bằng công thức hoá học, được sơ đồ phản ứng:
Fe + H2SO4 → FeSO4 + H2↑
Phương trình hóa học biểu diễn phản ứng hóa học bằng công thức hóa học của các chất tham gia và chất sản phẩm.
2. Thực hiện các bước lập phương trình hoá học
Một phương trình hoá học được xem là cân bằng khi nó thoả mãn định luật bảo toàn khối lượng, tức là số nguyên tử của mỗi nguyên tố ở hai vế phương trình phải bằng nhau.
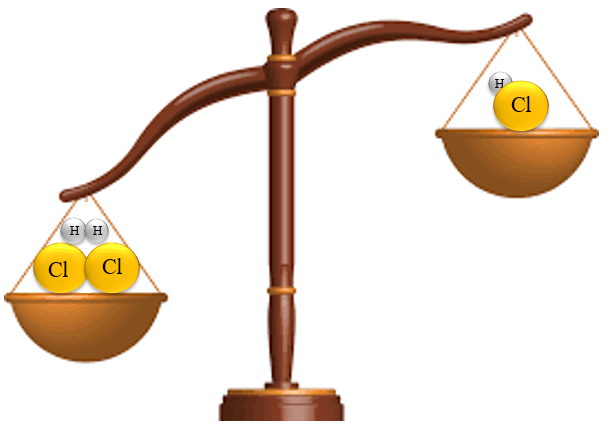

H2 + Cl2 ![]() 2HCl H2 + Cl2
2HCl H2 + Cl2 ![]() 2HCl
2HCl


Hình 2: Minh họa cân bằng phương trình hóa học
Để lập phương trình hoá học hay còn gọi là cân bằng số nguyên tử của các chất trong phản ứng, ta tiến hành theo 3 bước:
Bước 1: Viết sơ đồ phản ứng.
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố.
Bước 3: Viết phương trình hoá học hoàn chỉnh.
Ví dụ: Biết phosphorus tác dụng với khí oxygen tạo ra diphosphorus pentoxide (P2O5). Hãy thiết lập phương trình hóa học của phản ứng.
| Bước 1: Viết sơ đồ phản ứng | P + O2 |
| Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố |
Ta làm chẵn số nguyên tử O vế phải bằng cách đặt hệ số 2 trước P2O5: P + O2 Để số nguyên tử O vế trái bằng với vế phải, ta thêm hệ số 5: P + 5O2 Số nguyên tử P vế trái và vế phải chưa bằng nhau, ta đặt hệ số 4 trước P: 4P + 5O2 |
| Bước 3: Viết phương trình hóa học hoàn chỉnh | 4P + 5O2 |
Lưu ý:
- Không được thay đổi chỉ số trong những công thức hoá học đã viết đúng khi cân bằng hóa học.
Ví dụ: không thay 5O2 thành 10O.
- Nếu trong công thức hoá học có nhóm nguyên tử (ví dụ: nhóm (OH), nhóm (SO4), …) ta xem cả nhóm như một đơn vị để cân bằng.
Ví dụ: 2NaOH + H2SO4 ![]() Na2SO4 + H2O
Na2SO4 + H2O
3. Tìm hiểu ý nghĩa của phương trình hóa học
Phương trình hoá học cho biết tỉ lệ về số nguyên tử hoặc số phân tử giữa các chất trong phản ứng. Tỉ lệ này đúng bằng tỉ lệ hệ số mỗi chất trong phương trình.
Ví dụ, theo phương trình hóa học có tỉ lệ chung:
| 4Al | 3O2 | |
2Al2O3 | |
| 4 nguyên tử Al | : | 3 phân tử O2 | : | 2 phân tử Al2O3 |
Nội dung cùng chủ đề
-
Chủ đề 1: Phản ứng hóa học
-
Bài 1: Sử dụng hóa chất, dụng cụ và các thiết bị điện an toàn
-
Bài 2: Biến đổi vật lí và biến đổi hóa học
-
Bài 3: Phản ứng hóa học và năng lượng trong các phản ứng hóa học
-
Bài 4: Định luật bảo toàn khối lượng và phương trình hóa học
-
Bài 5: Mol và tỉ khối của chất khí
-
Bài 6: Tính theo phương trình hóa học
-
Bài 7: Nồng độ dung dịch
-
Ôn tập & kiểm tra Chủ đề 1
-
-
Chủ đề 2: Một số hợp chất vô cơ. Thang pH
-
Đề thi giữa học kì 1
-
Đề thi giữa học kì 1 Dạy song song
-
Chủ đề 3: Khối lượng riêng, áp suất và moment lực
-
Chủ đề 4: Điện
-
Đề thi học kì 1 Dạy nối tiếp
-
Đề thi học kì 1 Dạy song song
-
Chủ đề 5: Nhiệt
-
Chủ đề 6: Sinh học cơ thể người
-
Bài 29: Khái quát về cơ thể người
-
Bài 30: Hệ vận động ở người
-
Bài 31: Thực hành: Sơ cứu và băng bó gãy xương. Điều tra tình hình mắc bệnh về hệ vận động trong trường học và khu dân cư
-
Bài 32: Hệ tiêu hóa ở người
-
Bài 33: Dinh dưỡng và an toàn vệ sinh thực phẩm
-
Bài 34: Máu và hệ tuần hoàn của cơ thể người
-
Bài 35: Miễn dịch
-
Bài 36: Thực hành: Cấp cứu, băng bó vết thương, đo huyết áp ở người
-
Bài 37: Hệ hô hấp ở người
-
Bài 38: Thực hành: Hô hấp nhân tạo
-
Bài 39: Hệ bài tiết ở người
-
Bài 40: Điều hòa môi trường trong của cơ thể
-
Bài 41: Hệ thần kinh và các giác quan ở người
-
Bài 42: Hệ nội tiết ở người
-
Bài 43: Da và điều hoà thân nhiệt
-
Bài 44: Hệ sinh dục ở người và bảo vệ sức khỏe sinh sản vị thành niên
-
Ôn tập & kiểm tra Chủ đề 6
-
-
Đề thi giữa học kì 2 Dạy nối tiếp
-
Đề thi giữa học kì 2 Dạy song song
-
Chủ đề 7: Môi trường về hệ sinh thái
-
Đề thi cuối học kì 2 Dạy nối tiếp
-
Đề thi cuối học kì 2 Dạy song song







