Phản ứng hóa học và năng lượng trong các phản ứng hóa học
I. Phản ứng hóa học
Quá trình biến đổi chất này thành chất khác được gọi là phản ứng hoá học. Chất tham gia phản ứng gọi là chất đầu, chất mới tạo thành gọi là sản phẩm.
Ví dụ: Hỗn hợp sắt (iron) và lưu huỳnh (sulfur) đã phản ứng với nhau khi đun nóng để tạo thành hợp chất iron(II) sulfide (FeS).

Hình 1: Thí nghiệm giữa sắt và lưu huỳnh
Trong đó chất đầu là sắt và lưu huỳnh; sản phẩm là iron(II) sulfide.
II. Diễn biến của phản ứng hoá học
- Phân tử là hạt đại diện cho chất, thể hiện đầy đủ tính chất hóa học của chất. Khi các chất có phản ứng thì chính là các phân tử phản ứng với nhau.
- Trong phản ứng hóa học, chỉ có liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác. Kết quả là chất này bị biến đổi thành chất khác.
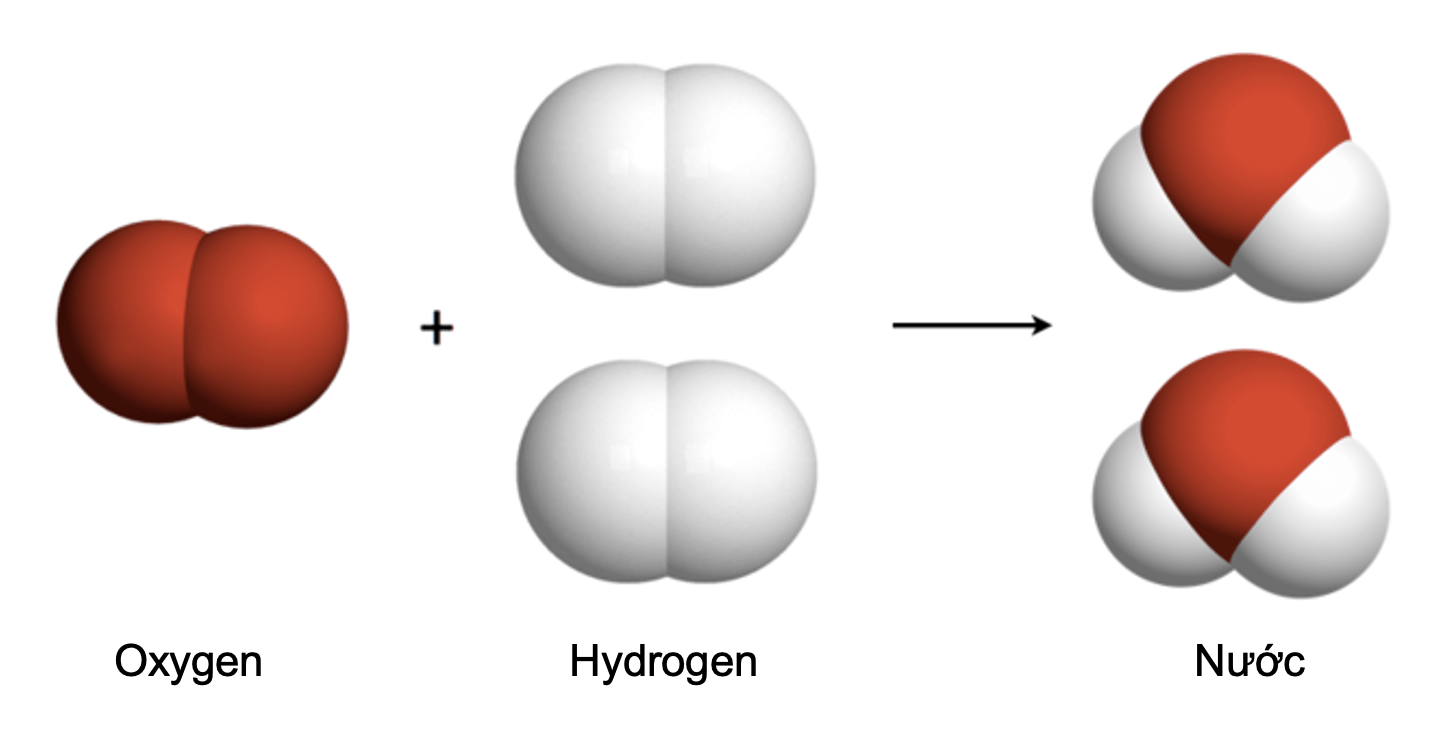 Hình 2: Sơ đồ minh họa phản ứng hóa học giữa hydrogen
Hình 2: Sơ đồ minh họa phản ứng hóa học giữa hydrogen
và oxygen tạo thành nước
Trong phản ứng hoá học, có sự phá vỡ liên kết cũ và hình thành liên kết mới. Kết quả là chất này biến đổi thành chất khác.
III. Một số dấu hiệu nhận biết có phản ứng hoá học xảy ra
 |
 |
| a) Củi cháy tỏa nhiệt. | b) Phản ứng phân hủy đường tạo thành than và hơi nước. |
 |
 |
| c) Sắt tác dụng với dung dịch hydrochloric acid tạo bọt khí. | d) Chất kết tủa tạo thành sau phản ứng. |
Hình 3: Một số dấu hiệu của phản ứng hóa học xảy ra
Một số dấu hiệu có thể nhận biết phản ứng hoá học xảy ra: xuất hiện chất khí, chất kết tủa; thay đổi màu sắc, mùi; phát sáng, giải phóng hoặc hấp thụ nhiệt năng, …
IV. Năng lượng trong phản ứng hoá học
1. Phản ứng toả nhiệt, phản ứng thu nhiệt
Trong một phản ứng hoá học, luôn có sự thay đổi năng lượng. Năng lượng có thể toả ra hoặc nhận vào, thường dưới dạng nhiệt. Vì vậy, ta có thể chia phản ứng thành hai nhóm: phản ứng toả nhiệt và phản ứng thu nhiệt.
Phản ứng tỏa nhiệt là những phản ứng hóa học kèm theo sự giải phóng năng lượng từ môi trường.
Những phản ứng toả nhiệt có thể được viết tổng quát như sau:
Chất phản ứng → Sản phẩm + năng lượng
Phản ứng thu nhiệt là phản ứng hóa học nhận năng lượng từ môi trường.
Những phản ứng thu nhiệt có thể được viết tổng quát như sau:
Chất phản ứng + năng lượng → Sản phẩm
2. Các ứng dụng phổ biến của phản ứng toả nhiệt
- Sự đốt cháy nhiên liệu (than, dầu hoả, gas, …) tạo ra năng lượng nhiệt phục vụ cho việc nấu nướng, sưởi ấm, …
- Quá trình hô hấp trong cơ thể cung cấp năng lượng để cơ thể hoạt động, đồng thời tạo nên thân nhiệt ổn định và hỗ trợ quá trình vận động.
 |
 |
| a) | b) |
|
Hình 4: Dùng than làm nhiên liệu nướng chín thực phẩm a); |
|
Nội dung cùng chủ đề
-
Chủ đề 1: Phản ứng hóa học
-
Bài 1: Sử dụng hóa chất, dụng cụ và các thiết bị điện an toàn
-
Bài 2: Biến đổi vật lí và biến đổi hóa học
-
Bài 3: Phản ứng hóa học và năng lượng trong các phản ứng hóa học
-
Bài 4: Định luật bảo toàn khối lượng và phương trình hóa học
-
Bài 5: Mol và tỉ khối của chất khí
-
Bài 6: Tính theo phương trình hóa học
-
Bài 7: Nồng độ dung dịch
-
Ôn tập & kiểm tra Chủ đề 1
-
-
Chủ đề 2: Một số hợp chất vô cơ. Thang pH
-
Đề thi giữa học kì 1
-
Đề thi giữa học kì 1 Dạy song song
-
Chủ đề 3: Khối lượng riêng, áp suất và moment lực
-
Chủ đề 4: Điện
-
Đề thi học kì 1 Dạy nối tiếp
-
Đề thi học kì 1 Dạy song song
-
Chủ đề 5: Nhiệt
-
Chủ đề 6: Sinh học cơ thể người
-
Bài 29: Khái quát về cơ thể người
-
Bài 30: Hệ vận động ở người
-
Bài 31: Thực hành: Sơ cứu và băng bó gãy xương. Điều tra tình hình mắc bệnh về hệ vận động trong trường học và khu dân cư
-
Bài 32: Hệ tiêu hóa ở người
-
Bài 33: Dinh dưỡng và an toàn vệ sinh thực phẩm
-
Bài 34: Máu và hệ tuần hoàn của cơ thể người
-
Bài 35: Miễn dịch
-
Bài 36: Thực hành: Cấp cứu, băng bó vết thương, đo huyết áp ở người
-
Bài 37: Hệ hô hấp ở người
-
Bài 38: Thực hành: Hô hấp nhân tạo
-
Bài 39: Hệ bài tiết ở người
-
Bài 40: Điều hòa môi trường trong của cơ thể
-
Bài 41: Hệ thần kinh và các giác quan ở người
-
Bài 42: Hệ nội tiết ở người
-
Bài 43: Da và điều hoà thân nhiệt
-
Bài 44: Hệ sinh dục ở người và bảo vệ sức khỏe sinh sản vị thành niên
-
Ôn tập & kiểm tra Chủ đề 6
-
-
Đề thi giữa học kì 2 Dạy nối tiếp
-
Đề thi giữa học kì 2 Dạy song song
-
Chủ đề 7: Môi trường về hệ sinh thái
-
Đề thi cuối học kì 2 Dạy nối tiếp
-
Đề thi cuối học kì 2 Dạy song song







