Muối
I. Khái niệm muối
1. Tìm hiểu về muối
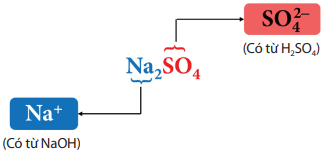
Muối là hợp chất được tạo ra khi thay thế ion H+ trong acid bằng ion kim loại hoặc ion ammonium (NH4+).
Ví dụ: Na2SO4 là muối có thành phần sau:
2. Tên gọi của muối
- Cách gọi tên muối của kim loại:
Tên kim loại + hoá trị (kim loại nhiều hoá trị) + tên gốc acid
- Cách gọi tên muối của ammonium (NH4+).
Ammonium + tên gốc acid
Ví dụ: một số muối và tên gọi tương ứng:
| Tên muối | Công thức hóa học |
| Potassium carbonate | K2CO3 |
| Iron(III) sulfate | Fe2(SO4)3 |
| Copper(II) chloride | CuCl2 |
| Ammonium nitrate | NH4NO3 |
| Sodium acetate | CH3COONa |
| Calcium phosphate | Ca3(PO4)2 |
II. Tính tan của muối trong nước
Tuỳ thuộc vào khả năng tan trong nước của muối, ta có: muối tan, muối không tan hoặc ít tan.
Một số muối tan được trong nước:
- Tất cả các muối của kim loại nhóm IA (Li, Na, K, …)
- Tất cả các muối ammonium.
- Tất cả các muối nitrate.
- Các muối sulfate ngoại trừ BaSO4, PbSO4.
- Các muối chloride ngoại trừ AgCl, PbCl2.
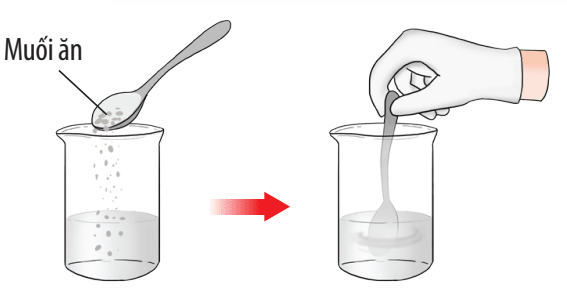
Hình 1: Hình minh họa hoà tan muối ăn (NaCl) vào nước
Một số muối không tan trong nước:
- Các muối carbonate ngoại trừ Na2CO3, K2CO3, (NH4)2CO3 …
- BaSO4, PbSO4 …
- AgCl, PbCl2 …
III. Điều chế muối
Các phương pháp điều chế muối từ:
- Oxide acid:
Oxide acid + Base → Muối + H2O
Ví dụ: SO2 + Ba(OH)2 → BaSO3 + H2O.
- Oxide base:
Oxide base + Acid → Muối + H2O
Ví dụ: FeO + 2HCl → FeCl2 + H2O
- Dung dịch acid và base:
Acid + Base → Muối + H2O
Ví dụ: HCl + NaOH → NaCl + H2O
- Kim loại và acid:
M + (HCl, H2SO4 loãng, …) → Muối + H2↑
M là một số kim loại như Mg, Al, Zn, Fe, …
Ví dụ: Fe + 2HCl → FeCl2 + H2↑
Ngoài ra, đa số kim loại tác dụng với phi kim thu được muối.
Ví dụ: Đốt dây sắt trong bình khí chlorine thu được muối FeCl3.
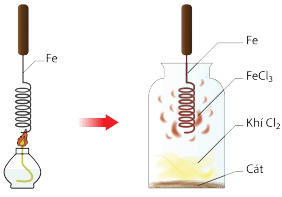
Hình 2: Đốt dây sắt trong bình khí chlorine
IV. Tính chất hoá học của muối
Một số tính chất hoá học của muối:
- Dung dịch muối phản ứng với kim loại (KL):
Muối KL(A) + KL(B) → Muối KL(B) + KL(A) (1)
Ví dụ: Fe + CuSO4 → FeSO4 + Cu.

Hình 3: Thí nghiệm sắt phản ứng với dung dịch copper(II) sulfate
Chú ý: Phản ứng trên xảy ra theo quy luật kim loại mạnh (không tan trong nước) đẩy kim loại yếu hơn ra khỏi dung dịch muối.
- Dung dịch muối phản ứng với dung dịch base:
Muối + Base → Muối mới + Base mới (2)
Ví dụ: 2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl.

Hình 4: Thí nghiệm cho dung dịch sodium hydroxide
tác dụng với dung dịch copper (II) sulfate
- Dung dịch muối phản ứng với dung dịch acid:
Muối + Acid → Muối mới + Acid mới (3)
Ví dụ: Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O.

Hình 5: Thí nghiệm cho dung dịch hydrochloric acid
phản ứng với dung dịch sodium carbonate
- Dung dịch muối phản ứng với dung dịch muối:
Muối (A) + Muối (B) → Muối (C) + Muối (D) (4)
Ví dụ: AgNO3 + NaCl → AgCl↓ + NaNO3
Chú ý: Điều kiện để có phản ứng (2), (3), (4) là sản phẩm phải có ít nhất một trong các chất sau: chất kết tủa, chất khí, nước.

Hình 6: Thí nghiệm cho dung dịch silver nitrate
phản ứng với dung dịch sodium chlorine
V. Mối quan hệ giữa acid, base, oxide và muối
Các hợp chất acid, base, oxide, muối có quan hệ với nhau theo sơ đồ sau:
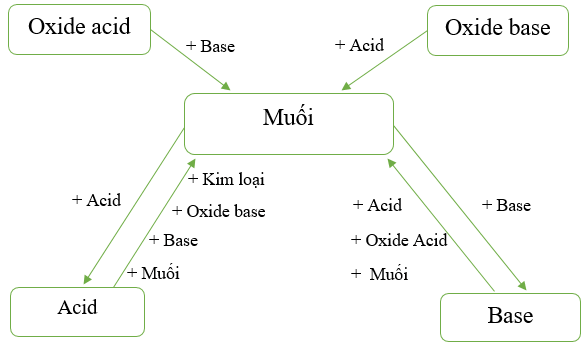
Hình 7: Sơ đồ mối quan hệ giữa acid, base, oxide, muối
Nội dung cùng chủ đề
-
Chủ đề 1: Phản ứng hóa học
-
Bài 1: Sử dụng hóa chất, dụng cụ và các thiết bị điện an toàn
-
Bài 2: Biến đổi vật lí và biến đổi hóa học
-
Bài 3: Phản ứng hóa học và năng lượng trong các phản ứng hóa học
-
Bài 4: Định luật bảo toàn khối lượng và phương trình hóa học
-
Bài 5: Mol và tỉ khối của chất khí
-
Bài 6: Tính theo phương trình hóa học
-
Bài 7: Nồng độ dung dịch
-
Ôn tập & kiểm tra Chủ đề 1
-
-
Chủ đề 2: Một số hợp chất vô cơ. Thang pH
-
Đề thi giữa học kì 1
-
Đề thi giữa học kì 1 Dạy song song
-
Chủ đề 3: Khối lượng riêng, áp suất và moment lực
-
Chủ đề 4: Điện
-
Đề thi học kì 1 Dạy nối tiếp
-
Đề thi học kì 1 Dạy song song
-
Chủ đề 5: Nhiệt
-
Chủ đề 6: Sinh học cơ thể người
-
Bài 29: Khái quát về cơ thể người
-
Bài 30: Hệ vận động ở người
-
Bài 31: Thực hành: Sơ cứu và băng bó gãy xương. Điều tra tình hình mắc bệnh về hệ vận động trong trường học và khu dân cư
-
Bài 32: Hệ tiêu hóa ở người
-
Bài 33: Dinh dưỡng và an toàn vệ sinh thực phẩm
-
Bài 34: Máu và hệ tuần hoàn của cơ thể người
-
Bài 35: Miễn dịch
-
Bài 36: Thực hành: Cấp cứu, băng bó vết thương, đo huyết áp ở người
-
Bài 37: Hệ hô hấp ở người
-
Bài 38: Thực hành: Hô hấp nhân tạo
-
Bài 39: Hệ bài tiết ở người
-
Bài 40: Điều hòa môi trường trong của cơ thể
-
Bài 41: Hệ thần kinh và các giác quan ở người
-
Bài 42: Hệ nội tiết ở người
-
Bài 43: Da và điều hoà thân nhiệt
-
Bài 44: Hệ sinh dục ở người và bảo vệ sức khỏe sinh sản vị thành niên
-
Ôn tập & kiểm tra Chủ đề 6
-
-
Đề thi giữa học kì 2 Dạy nối tiếp
-
Đề thi giữa học kì 2 Dạy song song
-
Chủ đề 7: Môi trường về hệ sinh thái
-
Đề thi cuối học kì 2 Dạy nối tiếp
-
Đề thi cuối học kì 2 Dạy song song