Mol và tỉ khối của chất khí
I. Mol
Để đại diện cho một lượng lớn các nguyên tử hay phân tử, các nhà khoa học đã đưa ra khái niệm mol.
Mol là lượng chất có chứa 6,022 × 1023 nguyên tử hay phân tử của chất đó. Số 6,022 × 1023 gọi là số Avogadro và được kí hiệu là N.
 |
 |
|
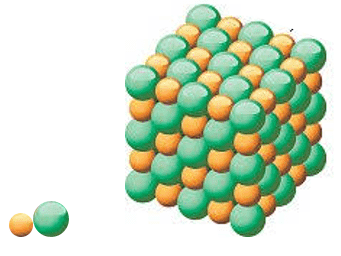
| 1 nguyên tử Fe và 6,022×1023 nguyên tử Fe | 1 phân tử NaCl và 6,022×1023 phân tử NaCl | |
| Hình 1 | ||
II. Khối lượng mol
1. Tìm hiểu khái niệm khối lượng mol
Khối lượng mol (kí hiệu là M) của một chất là khối lượng tính bằng gam của 1 mol chất đó. Đơn vị khối lượng mol là gam/mol (hay gam.mol-1).
Ví dụ:
Khối lượng mol nguyên tử Cu là 64 gam/mol.
Khối lượng mol phân tử nước là 18 gam/mol.
|
Khối lượng nguyên tử là 12 amu |
Khối lượng nguyên tử là 64 amu |
Công thức hóa học: H2O Khối lượng phân tử là 18 amu |
 |
 |
 |
| Đây là 12 gam carbon, chứa 1 mol hay 6,022 |
Đây là 64 gam copper chứa 1 mol hay 6,022 |
Cốc chứa 18 gam nước hoặc 1 mol hay 6,022 |
Khối lượng mol nguyên tử hay khối lượng mol phân tử của một chất có cùng trị số với khối lượng nguyên tử hay khối lượng phân tử chất đó.
2. Chuyển đổi giữa số mol và khối lượng
Gọi n là số mol chất (mol), M là khối lượng mol của chất (gam/mol) và m là khối lượng chất (gam), ta có công thức chuyển đổi sau:
![]()
Ví dụ 1: Tính khối lượng của 0,25 mol nguyên tử potassium. Biết rằng 1 mol nguyên tử potassium có khối lượng 39 gam.
Khối lượng 025 mol nguyên tử potassium: mK = 0,25×39 = 9,75 (g)
Ví dụ 2: Có bao nhiêu mol phân tử nitrogen có trong 56 gam N2? Biết rằng 1 mol phân tử nitrogen phân tử nitrogen có khối lượng là 28 gam.
Số mol phân tử nitrogen có trong 56 gam N2: ![]()
III. Thể tích mol chất khí
1. Tìm hiểu khái niệm thể tích mol
Một mol bất kì khí nào, trong cùng điều kiện nhiệt độ và áp suất đều chiếm những thể tích bằng nhau, người ta gọi đó là thể tích mol chất khí.
Ví dụ 1: Bơm vào 4 quả bóng bay 4 loại khí khác nhau và đều chứa cùng 1 mol chất khí ở nhiệt độ 25oC và áp suất 1 bar (0,987 atm).
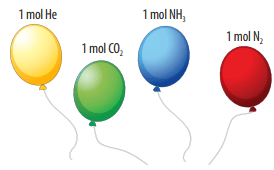
Hình 2: Minh họa thể tích mol các chất khí
Định luật Avogadro: Trong cùng điều kiện nhiệt độ và áp suất, các khí có cùng thể tích sẽ chứa cùng số mol.
Ở điều kiện chuẩn (đkc) áp suất 1 bar, nhiệt độ 25oC thì 1 mol bất kì khí nào cũng đều chiếm thể tích 24,79 lít.
Ví dụ 2: Thể tích 1 mol khí H2 cũng như 1 mol khí O2 ở điều kiện chuẩn đều là 24,79 lít.
2. Chuyển đổi giữa số mol và thể tích
Gọi n là số mol chất khí (mol), V là thể tích của chất khí ở đkc (lít), ta có công thức chuyển đổi sau:
![]()
Ví dụ 1: Hãy cho biết thể tích của 0,75 mol CO2 (đkc).
Thể tích của 0,75 mol CO2 ở đkc:
VCO2 = 0,75 ×24,79 = 18,5925 (l)
Ví dụ 2: Tính số mol Cl2 có trong 3,72 lít Cl2 ở đkc.
![]()
IV. Tỉ khối của chất khí
Tìm hiểu khái niệm tỉ khối chất khí
Ví dụ: Có hai chất khí A và B chứa sẵn trong 2 bình thủy tinh có cùng thể tích.
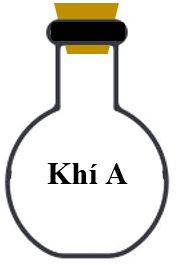
Để biết khí A nặng hay nhẹ hơn khí B bao nhiêu lần, ta so sánh khối lượng của hai thể tích khí bằng nhau ở cùng điều kiện nhiệt độ và áp suất, khi đó, theo định luật Avogadro:
![]()
Trong đó:
dA/B là tỉ khối của khí A đối với khí B;
mA và mB là khối lượng của khí A và khí B đo cùng thể tích;
nA và nB là số mol của khí A và khí B;
MA và MB là khối lượng mol của khí A và khí B (gam/mol).
Tỉ khối của chất khí A đối với khí B là tỉ số giữa khối lượng mol của khí A và khối lượng mol của khí B.
![]()
Ví dụ: Xác định khối lượng mol của khí A biết tỉ khối của khí A so với khí B là 1,8 và khối lượng mol của khí B là 30.
Tỉ khối của khí A so với khí B là: ![]() = 1,8
= 1,8
![]() MA = 1,8×MB = 1,8×30 = 54 (g/mol).
MA = 1,8×MB = 1,8×30 = 54 (g/mol).
Vậy khối lượng mol của khí A là 54 g/mol.
Nội dung cùng chủ đề
-
Chủ đề 1: Phản ứng hóa học
-
Bài 1: Sử dụng hóa chất, dụng cụ và các thiết bị điện an toàn
-
Bài 2: Biến đổi vật lí và biến đổi hóa học
-
Bài 3: Phản ứng hóa học và năng lượng trong các phản ứng hóa học
-
Bài 4: Định luật bảo toàn khối lượng và phương trình hóa học
-
Bài 5: Mol và tỉ khối của chất khí
-
Bài 6: Tính theo phương trình hóa học
-
Bài 7: Nồng độ dung dịch
-
Ôn tập & kiểm tra Chủ đề 1
-
-
Chủ đề 2: Một số hợp chất vô cơ. Thang pH
-
Đề thi giữa học kì 1
-
Đề thi giữa học kì 1 Dạy song song
-
Chủ đề 3: Khối lượng riêng, áp suất và moment lực
-
Chủ đề 4: Điện
-
Đề thi học kì 1 Dạy nối tiếp
-
Đề thi học kì 1 Dạy song song
-
Chủ đề 5: Nhiệt
-
Chủ đề 6: Sinh học cơ thể người
-
Bài 29: Khái quát về cơ thể người
-
Bài 30: Hệ vận động ở người
-
Bài 31: Thực hành: Sơ cứu và băng bó gãy xương. Điều tra tình hình mắc bệnh về hệ vận động trong trường học và khu dân cư
-
Bài 32: Hệ tiêu hóa ở người
-
Bài 33: Dinh dưỡng và an toàn vệ sinh thực phẩm
-
Bài 34: Máu và hệ tuần hoàn của cơ thể người
-
Bài 35: Miễn dịch
-
Bài 36: Thực hành: Cấp cứu, băng bó vết thương, đo huyết áp ở người
-
Bài 37: Hệ hô hấp ở người
-
Bài 38: Thực hành: Hô hấp nhân tạo
-
Bài 39: Hệ bài tiết ở người
-
Bài 40: Điều hòa môi trường trong của cơ thể
-
Bài 41: Hệ thần kinh và các giác quan ở người
-
Bài 42: Hệ nội tiết ở người
-
Bài 43: Da và điều hoà thân nhiệt
-
Bài 44: Hệ sinh dục ở người và bảo vệ sức khỏe sinh sản vị thành niên
-
Ôn tập & kiểm tra Chủ đề 6
-
-
Đề thi giữa học kì 2 Dạy nối tiếp
-
Đề thi giữa học kì 2 Dạy song song
-
Chủ đề 7: Môi trường về hệ sinh thái
-
Đề thi cuối học kì 2 Dạy nối tiếp
-
Đề thi cuối học kì 2 Dạy song song