Sơ lược về bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn\
Bảng hệ thống tuần hoàn có hơn 100 nguyên tố được sắp xếp theo chiều tăng dần của số điện tích hạt nhân nguyên tử.
II. Cấu tạo bảng tuần hoàn
1. Ô nguyên tố
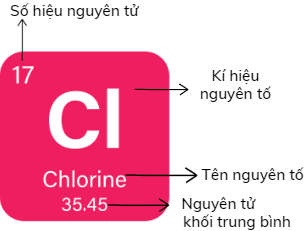 Ô nguyên tố Clo
Ô nguyên tố Clo- Bảng tuần hoàn có khoảng 110 ô, mỗi một nguyên tố được sắp xếp vào một ô gọi là ô nguyên tố.
- Ô nguyên tố cho biết: số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố
- Số hiệu nguyên tử là số thứ tự của nguyên tố trong bảng hệ thống tuần hoàn. Số hiệu nguyên tử có trị số bằng số đơn vị điện tích hạt nhân và bằng số electron trong nguyên tử.
Ví dụ: Ô thứ 11, xếp nguyên tố natri (Na).
Ta có:
- Số hiệu nguyên tử = số proton = số electron = 11
- Kí hiệu hóa học: Na
- Tên nguyên tố: natri
- Nguyên tử khối: 23
2. Chu kì
Chu kì là dãy các nguyên tố được sắp xếp theo hàng ngang
- Trong bảng tuần hoàn các nguyên tố gồm 7 chu kì. Trong đó 3 chu kì nhỏ (chu kì 1, 2, 3) và 4 chu kì lớn (chu kì 4, 5, 6, 7).
- Chu kì gồm các nguyên tố mà nguyên tử của chúng có cùng số lớp electron và được xếp thành hàng theo chiều tăng dần điện tích hạt nhân.
- Số thứ tự của chu kì bằng số lớp electron trong nguyên tử của các nguyên tố nằm trong chu kì.

Chu kỳ 2 của bảng tuần hoàn hóa học
Ví dụ: Chu kì 2: bắt đầu là kim loại kiềm Li và kết thúc là khí trơ: Ne (Neon)
3. Nhóm
Các nguyên tố mà nguyên tử của chúng có số electron lớp ngoài cùng bằng nhau ,do đó có tính chất hóa học tương tự nhau được sắp xếp vào một cột trong bảng tuần hoàn theo chiều tăng dần điện tích hạt nhân (từ trên xuống) tạo các nhóm trong bảng tuần hoàn.
Số thứ tự của nhóm bằng số electron lớp ngoài cùng của nguyên tử.

III. Sự biến đổi tính chất của nguyên tố trong bảng tuần hoàn
1. Trong một chu kì
Khi đi từ đầu chu kì đến cuối chu kì theo chiều tăng dần điện tích hạt nhân, ta có:
- Số electron ngoài cùng của nguyên tử tăng dần từ 1 đến 8 (trừ chu kì 1)
- Tính kim loại của nguyên tố giảm dần, tính phi kim tăng dần.
⇒ Như vậy đầu chu kì là kim loại mạnh (kim loại kiềm), cuối chu kì là phi kim mạnh (halogen: flo, clo..), kết thúc chu kì là khí hiếm.
Ví dụ: chu kì 3: đầu chu kì là kim loại kiềm Na (kim loại mạnh) cuối chu kì là phi kim mạnh clo, kết thúc chu kì là khí hiếm agon (Ar)
2. Trong một nhóm
Khi đi từ trên xuống theo chiều tăng điện tích hạt nhân, ta có:
- Số lớp electron của nguyên tử tăng dần
- Tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
IV. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
1. Biết vị trí của nguyên tử suy ra cấu tạo nguyên tử và tính chất của nguyên tố.
2. Biết cấu tạo nguyên tử suy ra vị trí và tính chất của nguyên tố.
-
Chương 1: Các loại hợp chất vô cơ
-
Bài 1: Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
-
Bài 2: Một số oxit quan trọng
-
Bài 3: Tính chất hóa học của axit
-
Bài 4: Một số axit quan trọng
-
Bài 5: Luyện tập tính chất hóa học oxit và axit
-
Bài 6: Thực hành: Tính chất hóa học của oxit và axit
-
Bài 7: Tính chất hóa học của bazơ
-
Bài 8: Một số bazơ quan trọng
-
Bài 9: Tính chất hóa học của muối
-
Bài 10: Một số muối quan trọng
-
Bài 11: Phân bón hóa học
-
Bài 12: Mối quan hệ giữa các hợp chất vô cơ
-
Thực hành Tính chất hóa học của bazơ và muối
-
Ôn tập & Kiểm tra Chương 1
-
-
Chương 2: Kim loại
-
Bài 15: Tính chất vật lí của kim loại
-
Bài 16: Tính chất hóa học của kim loại
-
Bài 17: Dãy hoạt động hóa học của kim loại
-
Bài 18: Nhôm
-
Bài 19: Sắt
-
Bài 20: Hợp kim sắt Gang, thép
-
Bài 21: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
-
Bài 22: Luyện tập chương 2 Kim loại
-
Bài 23: Thực hành tính chất hóa học của nhôm và sắt
-
Ôn tập & Kiểm tra Chương 2
-
-
Chương 3: Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
-
Bài 25: Tính chất của phi kim
-
Bài 26: Clo
-
Bài 27: Cacbon
-
Bài 28: Các oxit của cacbon
-
Bài 29: Axit cacbonic và muối cacbonat
-
Bài 30: Silic. Công nghiệp silicat
-
Bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
-
Bài 33: Thực hành tính chất hóa học của phi kim và hợp chất của chúng
-
Ôn tập & Kiểm tra Chương 3
-
-
Chương 4: Hiđrocacbon. Nhiên liệu
-
Chương 5: Dẫn xuất của Hiđrocacbon. Polime
-
Đề ôn thi Học kì








